Tin tức
Tế Bào Gốc Ung Thư (P4)
Vitex trifolia L. (Verbenaceae), một loại cây thuốc giàu flavonoid, đã được sử dụng truyền thống để điều trị đau và viêm do thấp khớp. Các đặc tính dược lý khác của Vitex bao gồm hoạt tính kháng khuẩn và bảo vệ gan. Gần đây, flavonoid từ Vitex đã được chứng minh là chất ức chế chu kỳ tế bào mới.
Mầm Triticum aestivum L. (cỏ lúa mì) chứa flavonoid có hoạt tính chống ung thư, giảm loét, chống oxy hóa, chống viêm khớp và làm mới máu trong bệnh Thalassemia Major. Ứng dụng lâm sàng chính của cỏ lúa mì có thể là do hàm lượng cao các bioflavonoid như apigenin, quercitin, luteoline. Hơn nữa, các hợp chất indole như choline và laetrile cũng có thể góp phần vào tiềm năng điều trị của nó.
Do có rất ít nghiên cứu về các loại thảo dược đầy hứa hẹn này, chúng tôi đã tiến hành nghiên cứu tác dụng chống ung thư của V. trifolia và T. aestivum chống lại một chất gây ung thư đã được chứng minh bằng kỹ thuật ngắn hạn, trong điều kiện in vitro, sử dụng microsome gan chuột. Ngoài ra, tác dụng hiệp đồng của các chiết xuất này cũng đã được nghiên cứu.
Mục lục
- VẬT LIỆU VÀ PHƯƠNG PHÁP
- KẾT QUẢ
- Phân hủy Microsome
- Hoạt tính chống tăng sinh
- Phân tích thống kê
- THẢO LUẬN
VẬT LIỆU VÀ PHƯƠNG PHÁP
Chuẩn bị chiết xuất
Lá V. trifolia L. (Verbenaceae) và mầm T. aestivum L. được thu thập từ vườn ươm cây của trường Đại học VIT, Vellore, Tamil Nadu, Ấn Độ trong tháng 9 và được Giáo sư Tiến sĩ Ayyanar, trường Cao đẳng Loyola, Chennai, Ấn Độ xác định. Lá V. trifolia và mầm T. aestivum được phơi khô trong bóng râm trong 1 tuần và nghiền thành bột mịn. Bột lá xay (25g) được chiết xuất với 250 ml ethanol 90% trong bộ chiết Soxhlet. Hỗn hợp ethanol được chuyển vào máy cô quay chân không để loại bỏ dung môi khỏi mẫu. Chiết xuất (khoảng 5 g) được bảo quản ở -20°C trước khi thử nghiệm.
Hóa chất
Các hóa chất được sử dụng trong nghiên cứu này được mua từ Sigma-Aldrich (Ấn Độ) và S.D. Fine Chem Ltd và có cấp độ phân tích.
Động vật
Chuột Wistar đực, nặng 120-150g đã được sử dụng. Việc chăm sóc động vật được thực hiện theo hướng dẫn của Ủy ban kiểm soát và giám sát các thí nghiệm trên động vật và được phê duyệt bởi Ủy ban Đạo đức Động vật của Viện (Số phê duyệt: VIT/IAEC/VIIth/34/2013).
Định lượng tổng hàm lượng phenol
Tổng hàm lượng phenol được xác định bằng phản ứng với thuốc thử Folin-Ciocalteu, như được mô tả bởi Singleton và Rossi và Kahkonen et al. Chiết xuất lá (1mg/ml) được trộn với 2 ml thuốc thử Folin-Ciocalteu (được pha loãng 10 lần trước đó bằng nước cất) và để ở nhiệt độ phòng trong 8 phút; 1.6 ml dung dịch Na2CO3 7.5% được thêm vào hỗn hợp. Các ống nghiệm được trộn đều và để trong bóng tối trong 30 phút, sau đó đo độ hấp thụ ở 765 nm (Hitachi U-2001). Kết quả được biểu thị bằng miligam tương đương acid gallic trên 100 mg chiết xuất thô (mg GAE/100 mg chiết xuất).
Định lượng hàm lượng flavonoid
Hàm lượng flavonoid được xác định theo quy trình của Zhishen et al.
Chiết xuất lá (1mg/ml) được trộn với 0.3 ml NaNO2 5% trong nước và để ở nhiệt độ phòng trong 5 phút; 0.6 ml dung dịch AlCl3 10% được thêm vào hỗn hợp. Sau 6 phút, 2 ml NaOH 1M và 2.1 ml nước được thêm vào hỗn hợp. Độ hấp thụ được đo ở 510 nm (Hitachi U-2001). Kết quả được biểu thị bằng miligam tương đương quercetin (Q) trên 100 mg chiết xuất thô (mg Q/100 mg chiết xuất).
Thử nghiệm phân hủy microsome
Năm con chuột được hy sinh cho mỗi thí nghiệm và gan của chúng được cắt nhỏ. 0.5g gan được thêm vào 1.25 thể tích dung dịch đệm sucrose tris (ST) 0.225M (pH 7.4) và hỗn hợp được đồng nhất trong điều kiện lạnh và xử lý để phân hủy microsome. Các mẫu đồng nhất mô được ly tâm trong 20 phút ở 9000 vòng/phút ở 4°C, phần dịch nổi sau ty thể được thu thập và trộn với 0.5g canxi clorua. Sau đó, các ống nghiệm được giữ trong đá trong 20 phút, ly tâm ở 4°C, 10.000 vòng/phút trong 20 phút. Các microsome kết tủa được tái hòa tan trong dung dịch đệm ST 0.225M (pH 7.4) và protein và RNA được định lượng theo các phương pháp tiêu chuẩn.
Thử nghiệm MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)
Khả năng sống của tế bào được xác định bằng cách sử dụng thử nghiệm MTT theo một quy trình đã được mô tả trước đó. Các tế bào HCT116 và A549, cả hai đều là tế bào ung thư có nguồn gốc lần lượt từ ung thư phổi và ung thư ruột kết, được thu hoạch bằng phương pháp trypsin hóa và tái hòa tan ở nồng độ cuối cùng là 2 × 10^4 tế bào/ml trong môi trường DMEM tươi với 2% huyết thanh Fetel bovine. Các phần mẫu 100 µl dịch huyền phù tế bào được mạ vào các đĩa nuôi cấy mô 96 giếng. Để phát hiện độc tính tế bào, các tế bào được xử lý với V. trifolia ở một loạt nồng độ 20, 40, 60 và 80µg/ml cùng với 100, 200, 400, 500µg/ml của T. aestivum trong 24 giờ. Sau 24 giờ, 20 µl dung dịch MTT 5 mg/ml được thêm vào mỗi giếng và đĩa được ủ trong 4 giờ, cho phép các tế bào sống khử MTT màu vàng thành tinh thể formazan màu xanh đậm, được hòa tan trong 100 µl DMSO. Độ hấp thụ trong từng giếng được xác định ở 570 nm bằng máy đọc vi đĩa [máy đọc độ hấp thụ ELx-800 biotek]. Khả năng sống của tế bào được tính toán dưới dạng tỷ lệ phần trăm của các tế bào sống và sau đó được vẽ trên biểu đồ.
Sự ức chế tăng trưởng (%) = (A570 nm của tế bào được xử lý/A570 nm của tế bào đối chứng) ×100
Phân tích thống kê
Dữ liệu được biểu thị dưới dạng trung bình ± độ lệch chuẩn của trung bình (SD).
KẾT QUẢ
Hàm lượng phenol và flavonoid
Đầu tiên, chúng tôi đã ước tính hàm lượng phenol và flavonoid của V. trifolia và T. aestivum vì các hợp chất này có thể đóng góp trực tiếp vào tiềm năng chống ung thư tổng thể của chiết xuất lá. Theo đó, tổng hàm lượng phenol của V. trifolia là 0,805 ± 0,04 mg acid gallic trên 100 mg chiết xuất và T. aestivum là 0,705 ± 0,022 mg acid gallic trên 100 mg chiết xuất [Bảng 1]. Tương tự, hàm lượng flavonoid của các chiết xuất đã được nghiên cứu để khám phá khả năng dập tắt của V. trifolia và T. aestivum trong việc giảm tổn thương oxy hóa cho tế bào như đã được chứng minh trước đây. Tổng hàm lượng flavonoid của V. trifolia là 0,487 ± 0,035 mg tương đương quercetin trên 100 mg chiết xuất và T. aestivum là 0,305 ± 0,022 mg tương đương quercetin trên 100 mg chiết xuất [Bảng 1].

Bảng 1 Nồng độ các hợp chất phenolic tổng số trong đương lượng axit gallic và flavonoid trong đương lượng quercetin trong GLE
Phân hủy Microsome
Các quan sát ghi nhận cho thấy 3,8-diamino-5-ethyl-6-phenylphenanthridinium bromide (EB) có khả năng gây phân hủy microsome đáng kể (P < 0,001) (62% dựa trên tỷ lệ RNA/protein) [Bảng 1]. Ứng dụng toàn bộ chiết xuất từ V. trifolia cho thấy 85% khả năng bảo vệ chống lại sự phân hủy microsome do EB gây ra, trong khi T. aestivum cho thấy 75% khả năng bảo vệ (P < 0,001). Kết hợp cả V. trifolia và T. aestivum cho thấy khả năng bảo vệ 91% (P < 0,001) [Bảng 2].
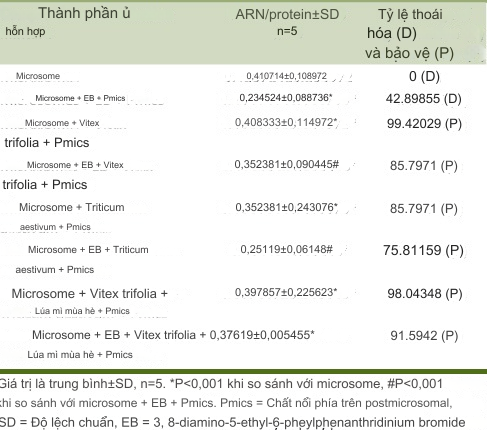
Bảng 2 Sự thoái hóa microsome gan do EB và sự ức chế của nó bởi Vitex trifolia và Triticum aestivum
Hoạt tính chống tăng sinh
Về cơ bản, xét nghiệm tăng sinh MTT dựa trên khả năng của các tế bào sống với enzym dehydrogenase ty thể hoạt động phân cắt các vòng tetrazolium của MTT, trong đó mật độ quang học thu được tỷ lệ thuận với số lượng tế bào sống khỏe mạnh. Trong nghiên cứu này, các tế bào ung thư HCT116 và A549 đã được xử lý với V. trifolia ở một loạt nồng độ 20, 40, 60 và 80 µg/ml cùng với 100, 200, 400, 500 µg/ml T. aestivum trong 24 giờ. Dựa trên biểu đồ được vẽ, giá trị IC50 đã được xác định. Hình 1 cho thấy các giá trị IC50 sau 24 giờ xử lý với sự kết hợp của 40 µg/ml V. trifolia và 200 µg/ml T. aestivum. Sự kết hợp hiệp đồng của hai chiết xuất này cho thấy sự giảm đáng kể trong sự tăng sinh của dòng tế bào A549 và HCT116.
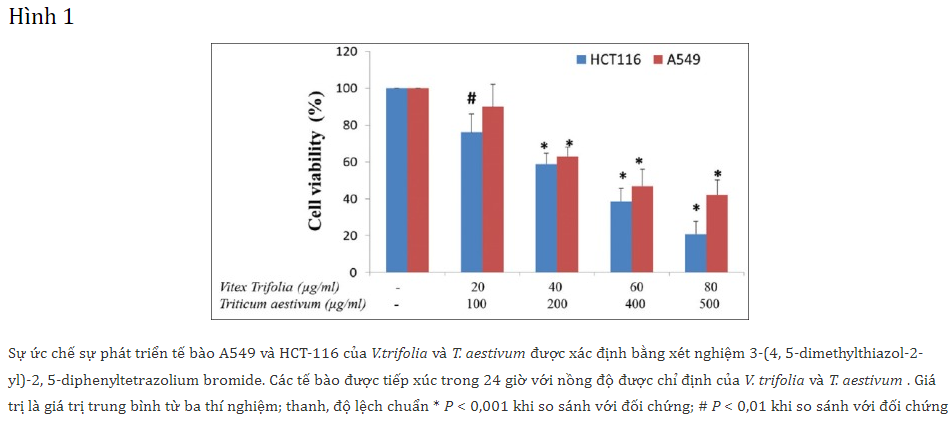
Phân tích thống kê
Dữ liệu được biểu thị dưới dạng trung bình ± độ lệch chuẩn (SD). Các thanh lỗi dọc biểu thị SD. Ý nghĩa của sự khác biệt giữa các nhóm được đánh giá bằng phân tích phương sai với bài kiểm tra Tukey hậu nghiệm khi so sánh ba hoặc nhiều nhóm. Giá trị P < 0,05 được coi là có ý nghĩa thống kê.
THẢO LUẬN
Trong nghiên cứu này, mô hình sử dụng tiềm năng gây ung thư của (EB) đã được đánh giá bằng cách đo sự tách ribosome khỏi lưới nội chất hạt (RER). Các nghiên cứu trước đây đã báo cáo rằng các chất gây ung thư làm mất hạt RER trong điều kiện in vivo và in vitro dẫn đến giảm tỷ lệ RNA/Protein và cung cấp cơ sở của một thử nghiệm sàng lọc cho các chất gây ung thư môi trường hoặc hóa học. Gan cung cấp một mô hình tốt cho việc nghiên cứu sự mất hạt do chất gây ung thư, vì nó là một nguồn phong phú của RER và nó có khả năng biến đổi trao đổi chất cần thiết để tạo ra các dạng hoạt động của chất gây ung thư ái điện từ các tiền chất. Trong nghiên cứu hiện tại, việc tiếp xúc với V. trifolia và T. aestivum, cả riêng lẻ và khi được sử dụng cùng nhau, dẫn đến tăng tỷ lệ RNA/Protein, được coi là một chỉ số bảo vệ sự mất hạt microsome. Kết quả của chúng tôi phù hợp với những phát hiện trước đó, sự gia tăng tỷ lệ RNA/Protein của chuột được điều trị do bảo vệ trực tiếp sự mất hạt màng đã được báo cáo. Các nhà nghiên cứu đã chứng minh rằng các chất ái điện của một chất gây ung thư gây ra sự mất hạt (loại bỏ ribosome) khỏi RER, liên quan đến quá trình tổng hợp protein để xuất ra khỏi tế bào chất. Mất mát ribosome được theo dõi bằng cách xác định tỷ lệ RNA/protein đối với màng do mất RNA cùng với ribosome. Sự tách ribosome khỏi bề mặt ngoài túi của RER có thể dẫn đến sự thay đổi trong mô hình tổng hợp protein của tế bào và thay đổi biểu hiện gen dẫn đến ung thư. Trong nghiên cứu này, chúng tôi nhận thấy rằng V. trifolia và T. aestivum ức chế đáng kể sự mất hạt microsome do chất gây ung thư gây ra, điều này chỉ ra vai trò điều hòa âm tính của các chiết xuất này trong quá trình gây ung thư. Đã có báo cáo rằng các flavonoid thực vật cho thấy sự giảm rõ rệt mức độ tách ribosome khỏi microsome.
Hơn nữa, việc điều trị kết hợp chiết xuất Triticum và Vitex đã được phát hiện là ức chế sự tăng sinh tế bào trong các tế bào ung thư HCT116 và A549. Từ những phát hiện của chúng tôi, rõ ràng là các flavonoid có trong Triticum và Vitex spp. có vai trò chống ung thư đáng kể. V. trifolia (80mg/ml) và T. aestivum (600mg/ml) đã được báo cáo về đặc tính chống ung thư của chúng. Hiệu ứng hiệp đồng cho thấy rằng việc bổ sung chiết xuất T. aestivum làm tăng đáng kể tiềm năng chống ung thư của V. trifolia. Đây là báo cáo đầu tiên cho thấy tác dụng hiệp đồng của các loại thảo mộc này và phát hiện này có thể có những ứng dụng rất quan trọng trong việc thiết kế thực phẩm chức năng và trong việc khám phá các chất dẫn đầu mới chống lại ung thư và các rối loạn khác. Do đó, trong liệu pháp thực vật, có những lợi thế tiềm năng đáng kể liên quan đến sự tương tác hiệp đồng của các chiết xuất thực vật khác nhau như tăng hiệu quả, giảm tác dụng không mong muốn, tăng độ ổn định và đạt được hiệu quả điều trị đầy đủ với liều tương đối nhỏ, khi so sánh với thuốc tổng hợp.
Nguồn và phiên dịch : BS Hoàng Đôn Hòa – Mednews.vn
